NK细胞作为先天免疫系统的关键组成部分,在临床肿瘤治疗上发挥着关键作用。但传统NK细胞疗法面临供体异质性、扩增效率低、体内持久性差等挑战。与其他来源NK细胞相比,iPSC-NK细胞通过重编程技术可实现持久扩增、基因编辑和标准化生产,成为"现货型"细胞疗法的理想载体,是近几年肿瘤免疫疗法的研究热点[1]。
iPSC-NK全球临床进展
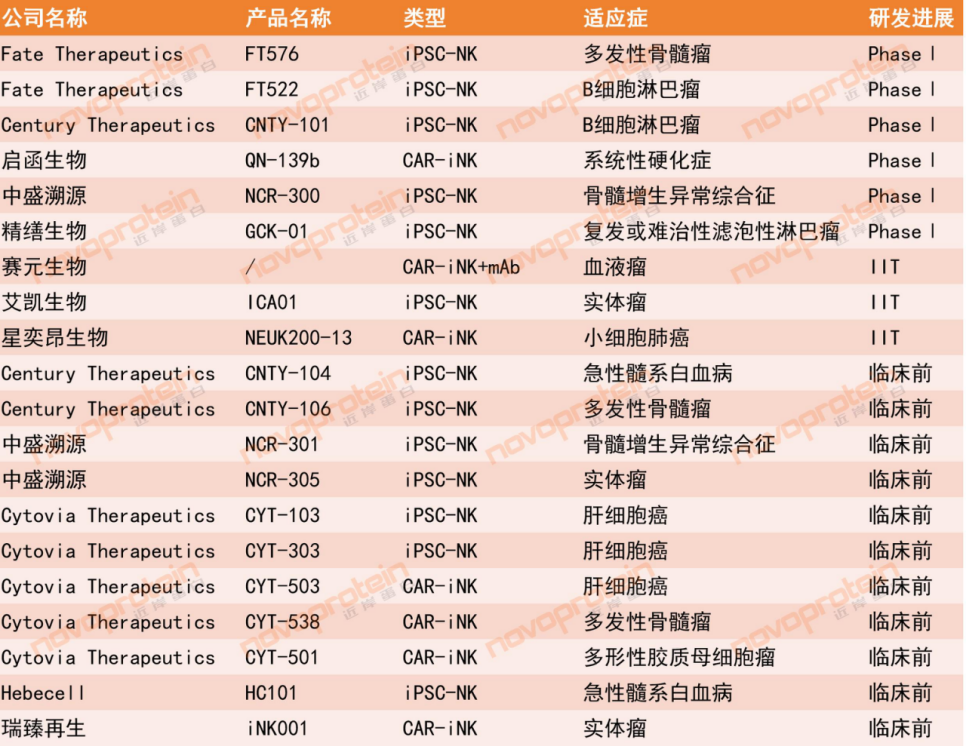
Novoprotein整理,如有错漏,欢迎指正
目前,全球iPSC衍生出的NK细胞疗法管线相对较少,主要包括iNK和CAR-iNK两大类型,相关研究仍处于临床前或早期临床阶段。进展最快的是Fate Therapeutics(FT522、FT576)和Century Therapeutics(CNTY-101)相关的项目。
iPSC-NK培养方案
本文将介绍在无饲养层细胞、无血清条件下生成iPSC来源的CD56+/CD3- NK细胞培养方案[2],这些细胞表达NKG2D、NKp30等激活受体,并展现出对A549肺癌、PC3前列腺癌及GBM10胶质瘤等实体瘤靶点的细胞毒性、脱颗粒和IFN-γ分泌功能。
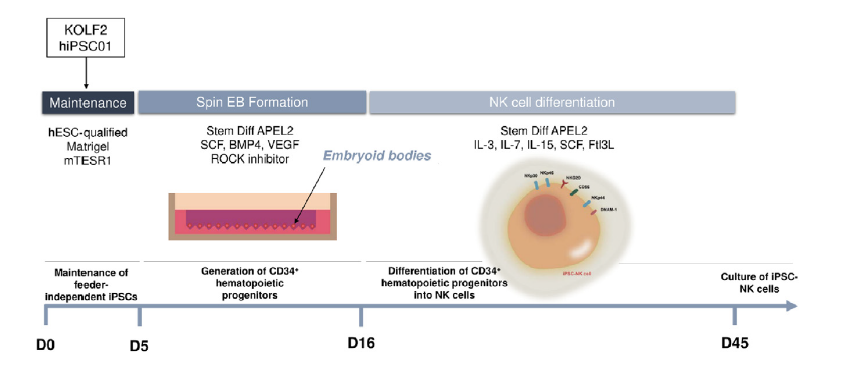
图2 iPSC-NK的培养流程[2]
材料准备
|
样本:人iPSC细胞 |
|
造血分化诱导培养基(HPDM) 培养基:STEMdiffTM APEL 2 细胞因子及小分子:40 ng/mL SCF、20 ng/mL BMP4、 20 ng/mL VEGF、10 μM ROCK 抑制剂 |
|
NK分化培养基 培养基:STEMdiffTM APEL 1 细胞因子:20 ng/mL SCF、20 ng/mL IL-7、10 ng/mL IL-15、10 ng/mL FLT3L、5 ng/mL IL-3 |
|
NK扩增培养基 培养基:T细胞培养基、5% hAB血清、1%青霉素/链霉素、0.2 mM L-谷氨酰胺 细胞因子:10 ng/mL IL-15、500 IU/mL IL-2、25 ng/mL IL-21 |
|
其他试剂:hPSC培养基、EDTA、基质胶 |
|
耗材:6孔板、24孔板、超低吸附96孔圆底板、离心管等 |
复苏和培养iPSC
复苏iPSC,用hPSC培养基培养4-5天至80%汇合度。用0.5 mM EDTA/PBS消化传代。
iPSC细胞向造血组细胞分化(0-11天)
-
将iPSC以3000个/孔接种于超低吸附96孔圆底板,每孔加入100 μL 的含10 μM ROCK 抑制剂的造血分化诱导培养基(HPDM);
-
将接种了细胞的培养板以220 g离心5 min以促进EB形成, 并在37°C、5% CO₂静置培养3天;
注:接种细胞数少于或多于3000个均会导致EBs出现形态异常,导致经11天分化后造血前体细胞的产量降低。
-
在第3、6、9天进行换液,从每孔中移除70 μL培养基,并加入100 μL不含ROCK抑制剂的HPDM;
-
第11天用大口径P200移液管将EB转移至NK细胞分化培养基中。在此阶段可收集造血祖细胞用于流式细胞术分析,所述细胞表达为CD34+,被视作成功诱导出造血祖细胞群体。
注:
1)在进行第3天造血细胞分化后,这些培养物形成了类胚体结构,并在随后的8天内表现出造血前体细胞的发育与增殖。
2)若类胚体培养物在整个11天的分化过程中保持圆形形态并持续生长,则被视为健康状态。形状圆润、表面光滑且生长连续的类胚体,其分化后获得的NK细胞纯度更高。
造血组细胞向NK分化(11天-4周)
-
将造血祖细胞以32个EBs/孔接种于6孔板,每孔4 mL NK分化培养基,仅第1周添加5 ng/mL的IL-3,后3 周加入不含 IL-3 的 NK 分化培养基,每周2次换液,采用半量换液的方式;
-
经过4周的NK细胞分化培养后,收集细胞,通过流式细胞术进行表型分析,所述细胞表达为CD56+CD3-。
NK细胞扩增(第4周末-8周)
在T细胞扩增培养基中扩增3-4周,该扩增培养基补充有5% hAB血清、1%青霉素/链霉素、0.2 mM L-谷氨酰胺、10 ng/mL的IL-15、500 IU/mL的IL-2和25 ng/mL的IL-21,之后进行细胞毒性和功能实验。
NK细胞的鉴定
常用表面标记物组合
CD3-/CD56+是检测血液循环中典型 NK 细胞的组合标志物。
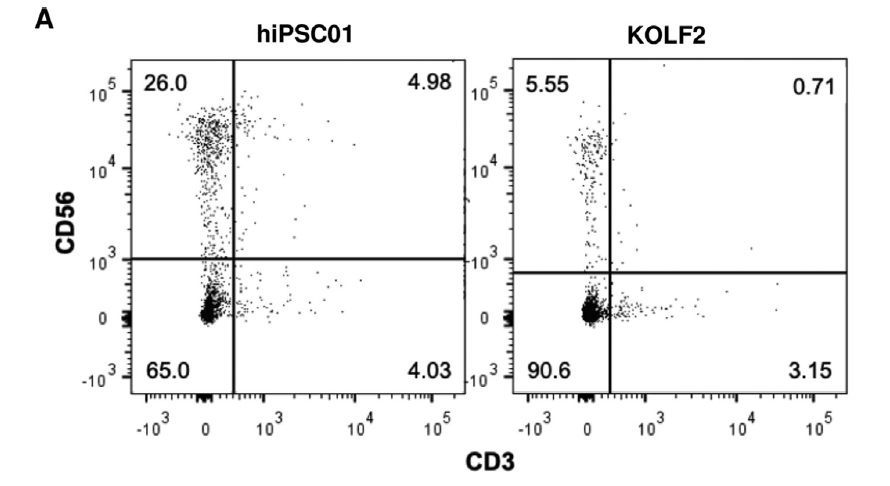
NK细胞表面标记物鉴定[2]
NK细胞功能评估相关标志物
活化标志物在肿瘤杀伤过程中起到重要作用。常用检测指标:NKp44、NKp46、NKp30、NKG2D等;抑制性受体确保 NK细胞不攻击正常健康细胞。常用检测指标为:NKG2A、KIRS等。
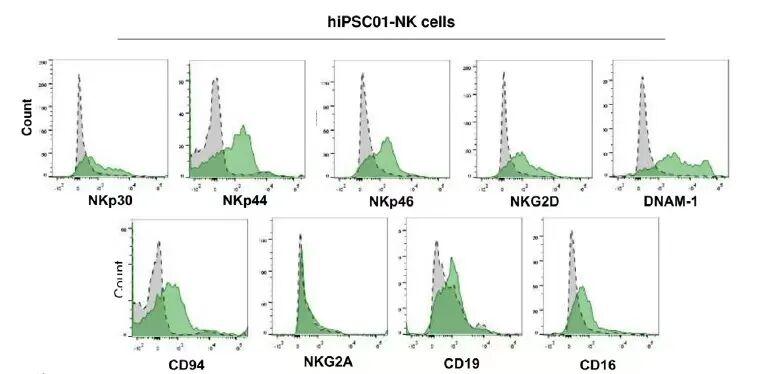
NK功能相关标志物[2]
近岸蛋白可提供iPSC诱导分化NK细胞过程中用到的一系列细胞因子,包括BMP4、bFGF、VEGF、FLT3L、SCF、IL-3、IL-7、IL-15等,以及iPSC扩增培养常用Vitronectin、Laminins等基质蛋白,高活性,高稳定性,高批间一致性,助力高效稳定的iPSC研究!

iPSC-NK相关产品列表
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考文献
[1] Wei X, Su C, Liu Y, Wei N, Xiang K, Qian Q, Xu Z. IPSCderived NK cells for immunotherapy and therapeutic perspective (Review). Mol Med Rep. 2025 Aug;32(2):222. doi: 10.3892/mmr.2025.13587. Epub 2025 Jun 6. PMID: 40476558; PMCID: PMC12174902.
[2]Lupo KB, Moon JI, Chambers AM, Matosevic S. Differentiation of natural killer cells from induced pluripotent stem cells under defined, serum- and feeder-free conditions. Cytotherapy. 2021 Oct;23(10):939-952. doi: 10.1016/j.jcyt.2021.05.001. Epub 2021 Jul 14. PMID: 34272175.
