前言
肠道上皮作为人体与肠道内容物之间的第一道屏障,其完整性对阻止病原与有害分子进入至关重要。为维持组织稳态,上皮细胞持续自我更新:新生细胞自隐窝涌出,沿绒毛轴向上迁移,最终在绒毛顶端被外排或挤出(extrusion)肠腔,完成生命周期的“有序清退”。这一过程长期伴随一个关键疑问——为何细胞会在特定的位置与时机“选择离开”?流行的解释强调局部过度拥挤所致的压力,但该模型缺乏直接证据,尤其受限于对哺乳动物肠道内部力学与细胞动态的原位、长时程解析能力。
细胞挤出如何被触发与执行,直接关系到肠上皮稳态,以及外排障碍在炎症性肠病与簇状肠病等病理中的作用机制。2025年9月4日,乌德勒支大学Hans Clevers团队与洛桑联邦理工学院、荷兰AMOLF研究所Oncode研究所及荷兰代尔夫特理工大学等团队在顶刊Science发表论文“Epithelial tension controls intestinal cell extrusion”,利用活体组织及能够捕捉原代组织结构与分子特征的小鼠肠道类器官,结合光遗传学、激光消融和长时间活细胞成像,提出了一个全新的解释:细胞挤出的根本驱动力并非来自于密度过高导致的拥挤,而是细胞之间的机械拉锯战。这种贯穿基底面的肌球蛋白II收缩网络带来的组织张力像持续的拔河,把难以承载拉力的那枚“弱环”优先推离上皮层。该工作提出的张力模型不仅为肠道挤出的时空规律给出了力学框架,也为精准干预肠道屏障相关疾病提供了可操作的工具与思路。
01 从“拥挤模型”到“拉锯模型”
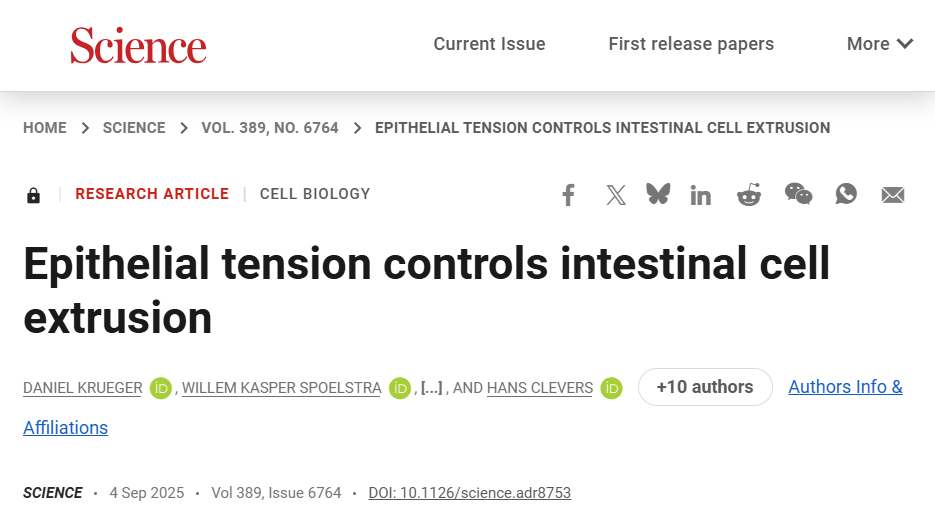
以往的假说认为:绒毛顶端因局部密度过高,细胞被“挤”得无处可去,只能被动外排。本文中,研究者首先通过补充Noggin、R-spindin 1、EGF、Wnt等细胞因子,生成了小鼠肠道类器官并进行了长时程活细胞成像,通过用 H2B 荧光标记细胞核并自动跟踪,几天内统计了大量挤出事件。
结果发现,细胞挤出并不偏好密度最高的区域,反而常常出现在平均或偏低密度处。于是研究团队提出一个新假设:决定细胞去留的关键不是“拥挤-压缩”模型,而是张力模型。
进一步的单细胞追踪表明,挤出事件与局部的收缩力动态密切相关。在绒毛样区域,基底面上肌球蛋白II的活性高度富集,形成了一个动态的收缩网络,进一步证明了张力的存在。
而在野生型(WT)小鼠小肠激光消融实验中,一旦切断局部结构,组织立即外向回缩,证明绒毛上皮处于被拉紧而非被压缩的状态。换句话说,绒毛顶端的细胞更像是被这张张力网“拉”出去,而不是因为拥挤被“挤”出去。
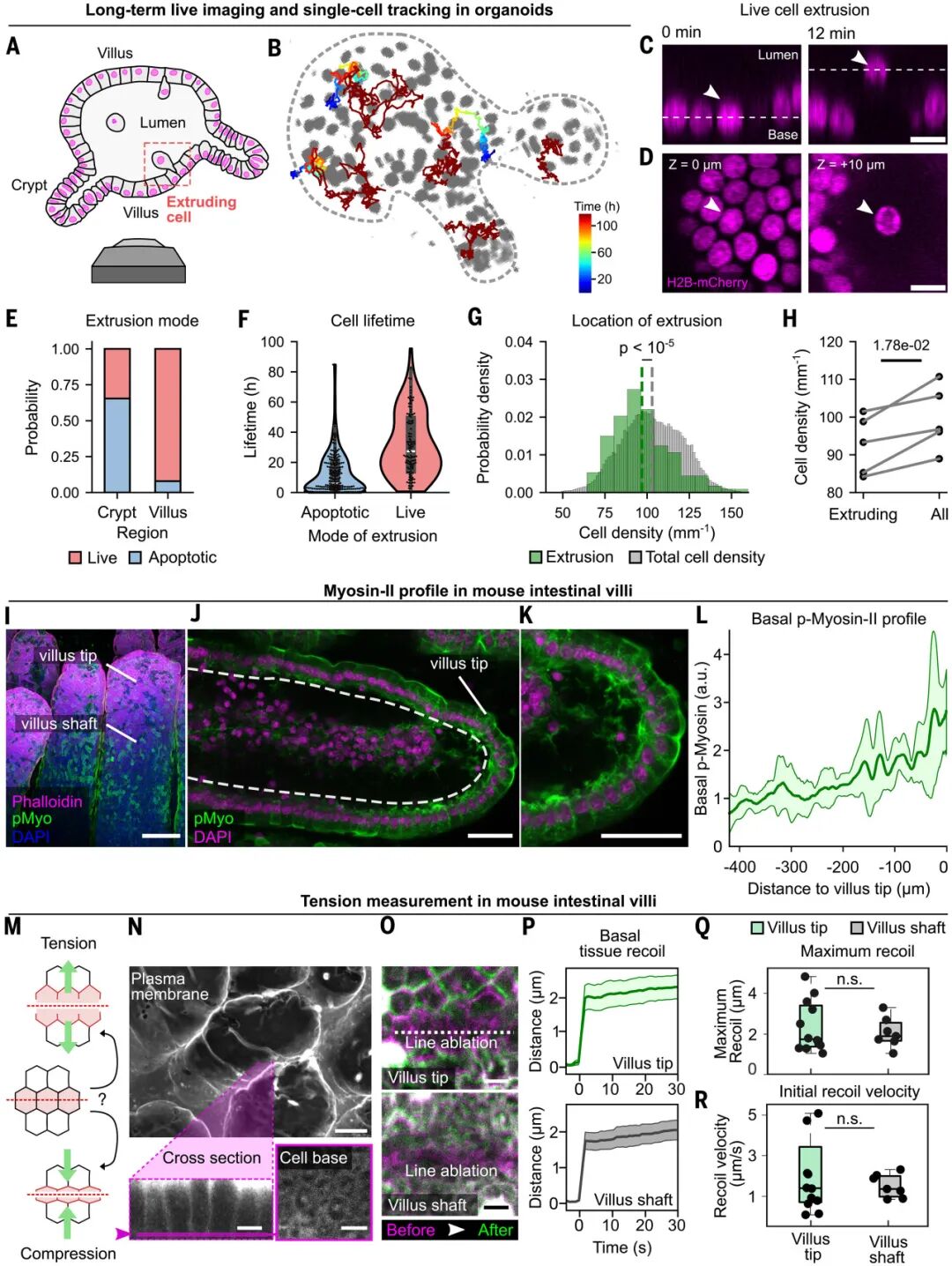
图:肠道活细胞挤出主要发生在受张力的区域,提示拥挤密度模型不适用
02 起底张力的来源:高度动态的基底皮质肌球蛋白网络
进一步的实验揭示了这一张力的分子基础。在肠道类器官的基底面,研究者通过超分辨显微镜观察到肌球蛋白II不仅分布在细胞边界的连接带,还在细胞中央汇聚成放射状结构,构成了一个跨细胞的互联网络。这一网络并非静态,而是以脉冲式的方式不断收缩与放松。
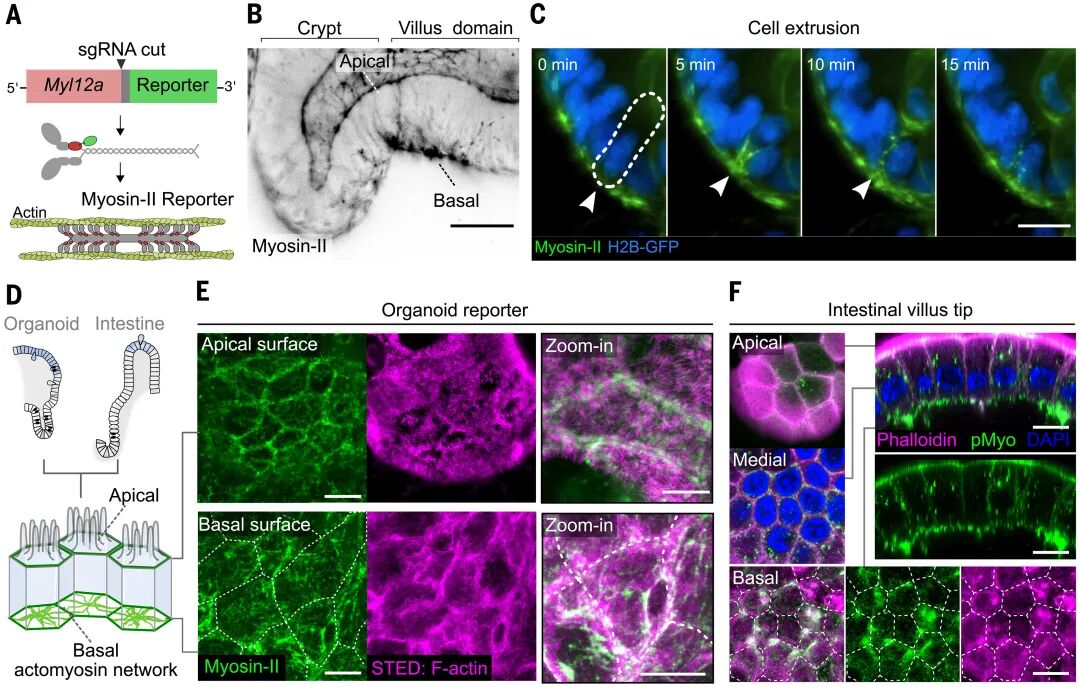
图:基底肌动球蛋白网络连接肠上皮细胞
具体而言,研究在类器官中通过CRISPR给肌球蛋白II的内源位点敲入荧光标签,同时配合超分辨和三维成像,比对顶端与基底两侧的网络结构与动态,发现当某个细胞收缩时,邻近细胞会被迫扩张;而当它放松时,周围细胞则会回缩。这种动态的互作就像一场持久的“拔河”,使得整个组织保持在持续的张力状态中。
由此,类器官为研究提供了窗口,直接可视化了绒毛区域细胞的力学博弈,并证明绒毛样上皮底盘由会跳动的收缩单元拼成,具备随时向外输出张力的能力。
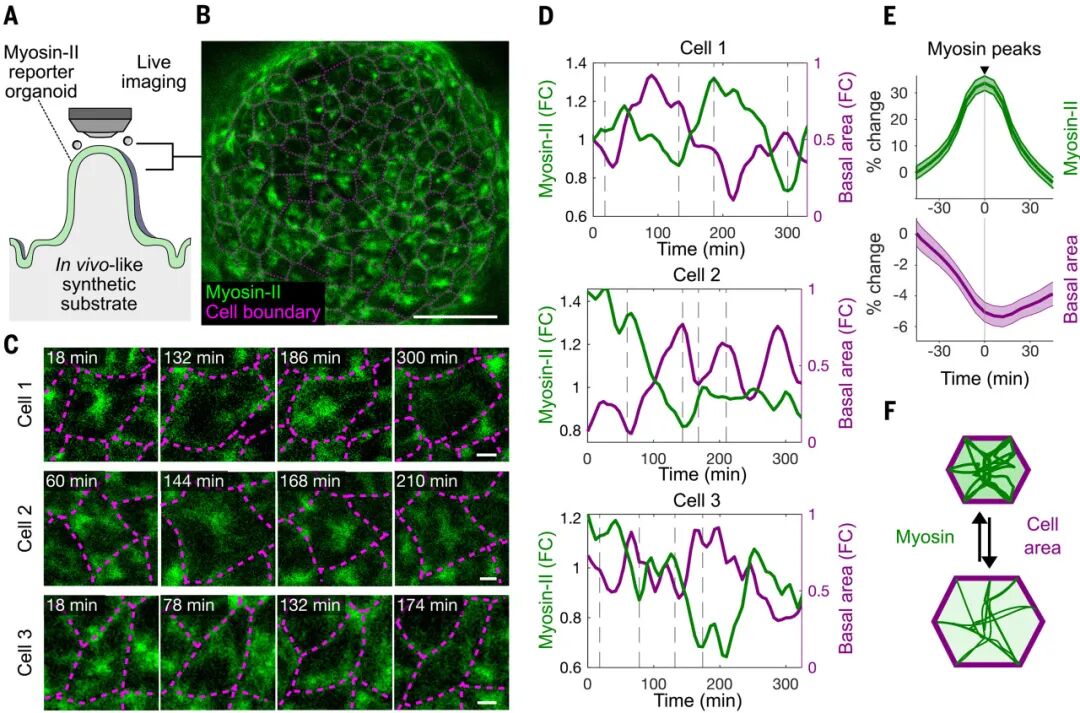
图:肠上皮细胞利用其基底细胞骨架对邻近细胞施加高度动态的拉力
值得注意的是,破坏基底皮层完整性及细胞骨架导致的张力丧失会直接导致细胞的挤出。该结果进一步证明了基底面肌球蛋白II网络的张力直接调控挤出事件。
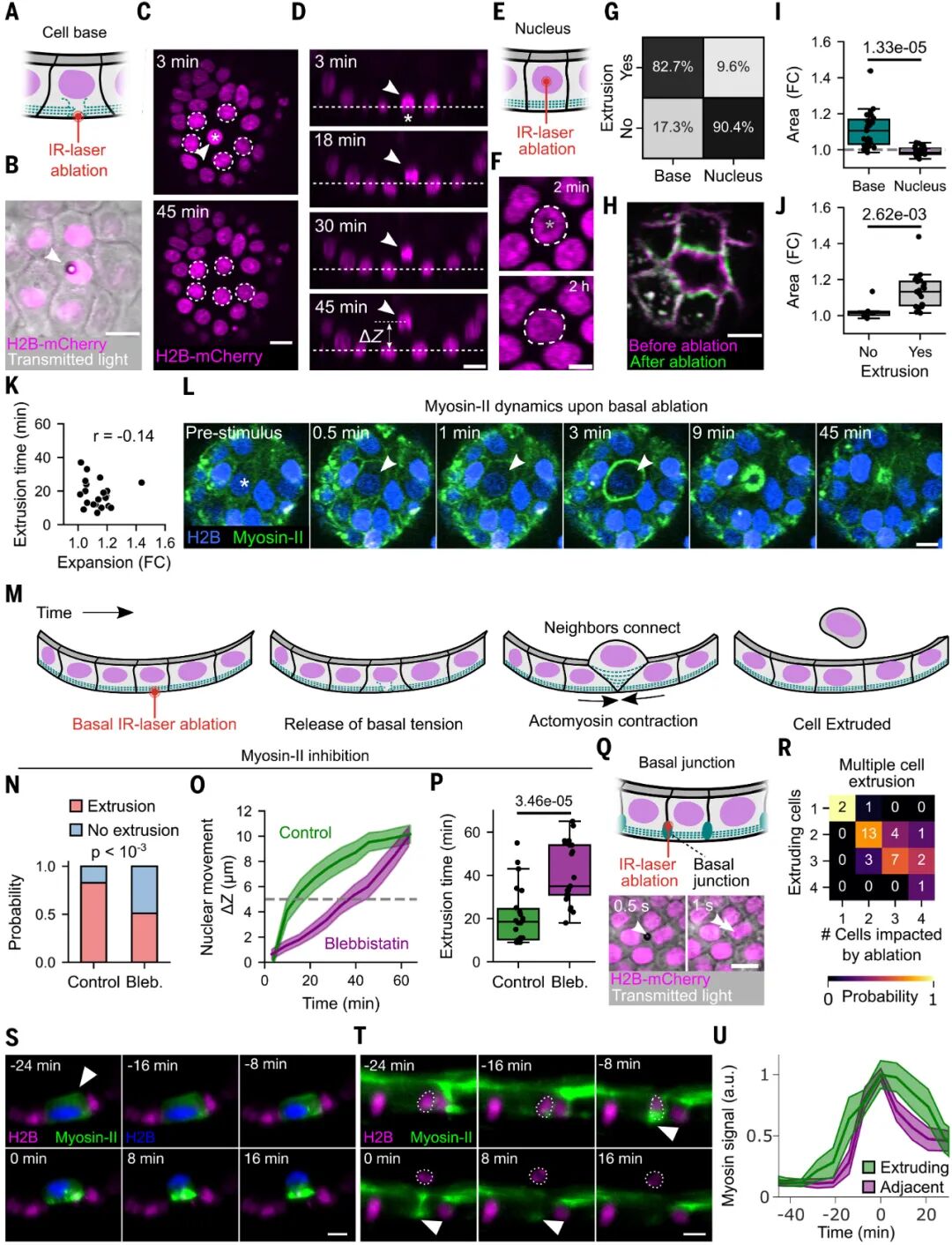
图:组织张力的释放引发细胞挤压
03 谁会被淘汰?弱者出局的力学逻辑
如果张力是关键,那么哪些细胞更容易被挤出?团队利用光遗传学手段精确操控单细胞的肌球蛋白II活性,结果显示:当某些细胞被增强收缩能力时,邻近的正常细胞更容易被挤出;反之,当细胞因遗传操作或激光破坏而失去张力生成能力时,它们自己会迅速被排除。
这揭示了一个清晰的逻辑:谁的张力弱,谁就会被踢出局。马赛克类器官实验进一步印证了这一点——在由强收缩细胞和弱收缩细胞混合的类器官中,弱者被挤出的概率显著升高。这种竞争性挤出机制,确保了组织能够不断清除最脆弱的环节,从而维护屏障的完整。
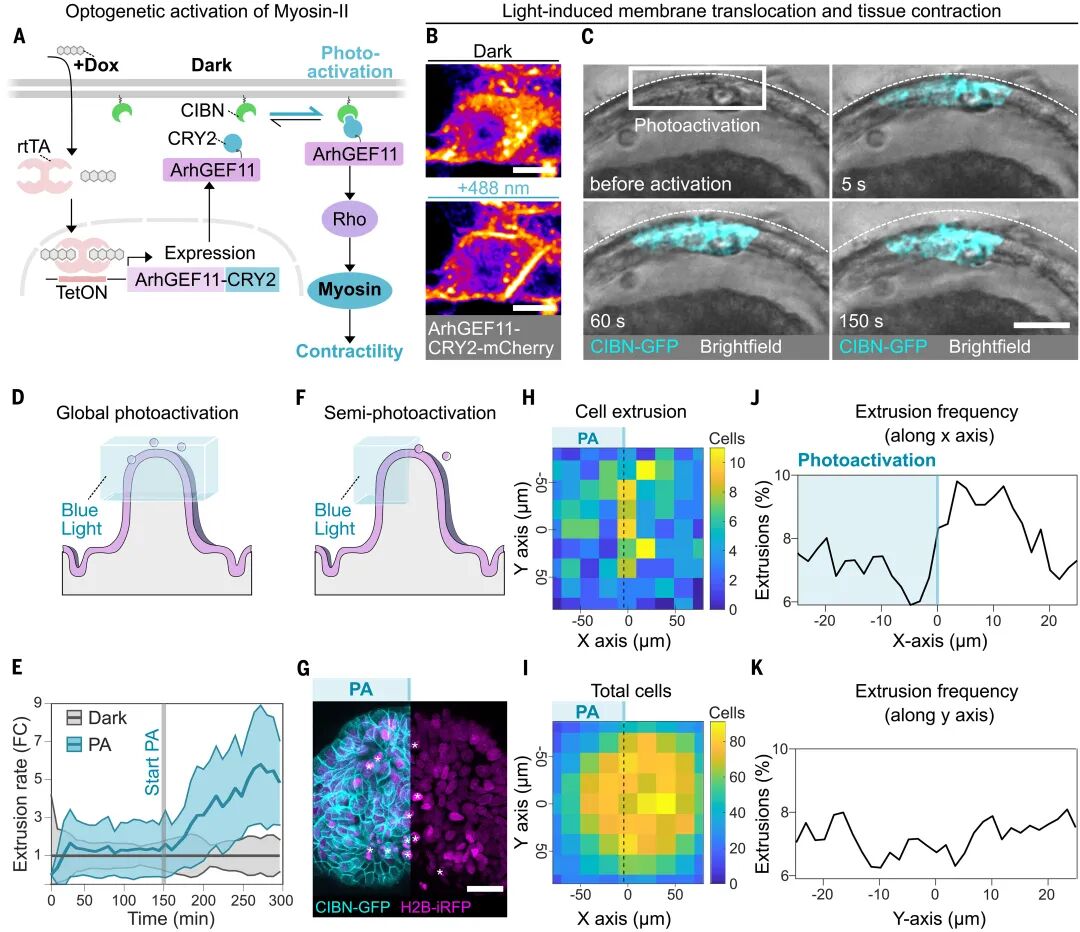
图:细胞间张力的差异影响绒毛尖端的细胞挤出
04 先天性簇绒肠病的力学根源
这一发现不仅是基础生物学的突破,还为临床疑难病提供了新视角。先天性簇绒肠病(CTE)是一种罕见的婴幼儿疾病,由上皮细胞粘附分子(EpCAM)基因缺陷导致,患者表现为严重腹泻和营养吸收障碍。研究团队在CRISPR敲除EpCAM的类器官中发现,细胞表现出异常的肌球蛋白II过度活化,组织结构紊乱,挤出率显著升高。
更关键的是,在EpCAM缺陷与正常细胞混合的马赛克类器官中,正常细胞反而被优先挤出,而缺陷细胞得以残留。这意味着异常的张力分布打破了原有的力学平衡,使得“健康细胞”成了竞争中的输家。这一结果为CTE的病理机制提供了直观解释:疾病的根源不仅是分子缺陷,更是力学网络的紊乱。
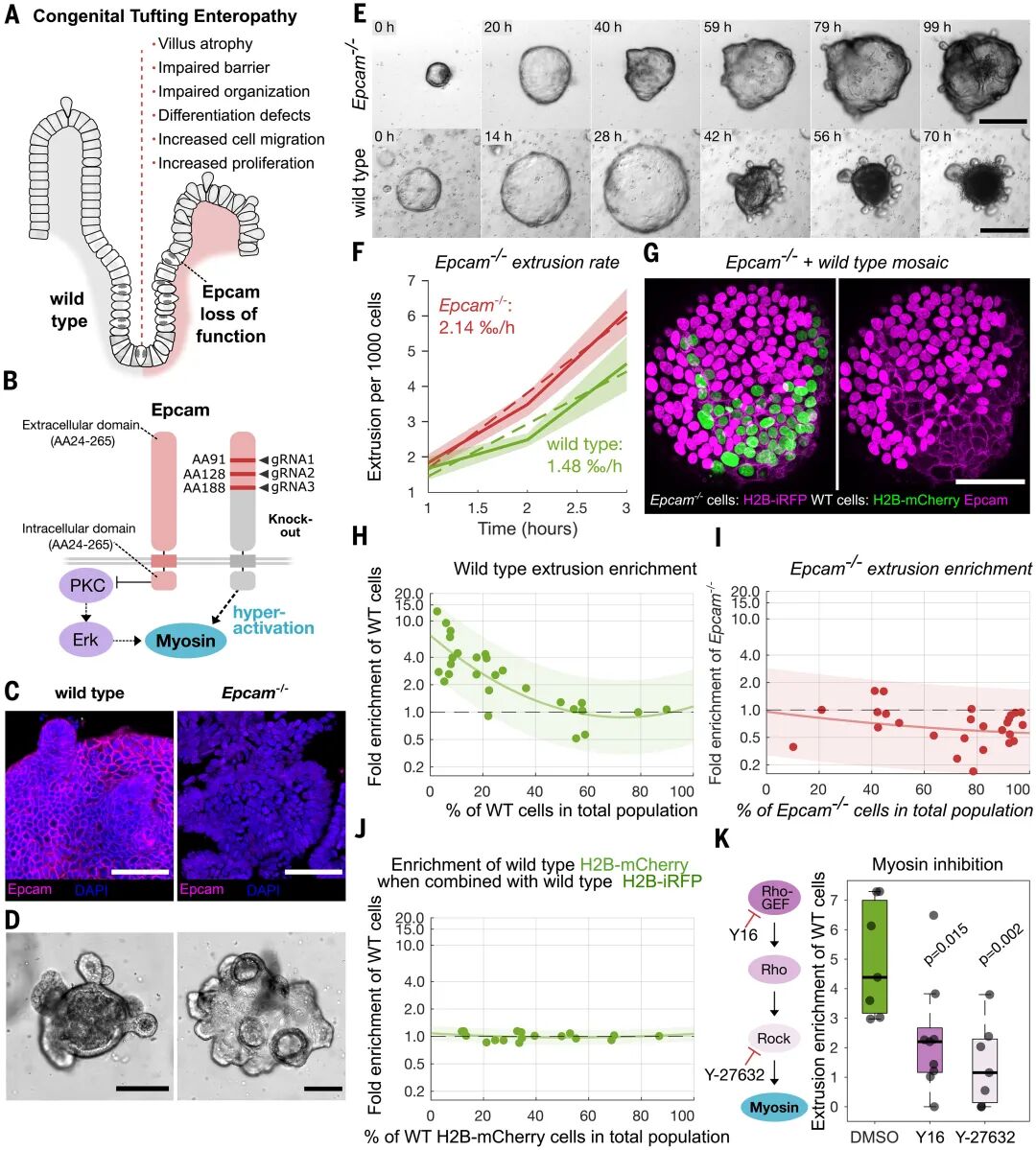
图:CTE中EpCAM缺失导致肌球蛋白II过度活化,破坏上皮稳态并导致竞争性细胞挤出
05 总结
本研究揭示了肠道细胞外排的力学调控机制,提出了一个基于张力的细胞外排模型。在这个模型中,动态的肌动球蛋白网络产生组织水平上的张力,无法产生足够力来抵抗邻近细胞拉力的细胞会被优先移除。这种“拔河比赛”机制通过消除组织中最弱的细胞来维持机械完整性。这一发现为理解肠道如何维持稳态提供了新的视角,为开发新的疾病治疗方法提供了潜在的靶点。
类器官在本研究里承担了“可控、可复现、可因果”的核心角色:它在三维环境中重建了隐窝—绒毛轴,既能长时程追踪细胞命运,又能叠加内源肌球蛋白示踪、光遗传收缩开关(opto-Arhgef11)、激光微手术和仿生水凝胶等模块,构成从“观测张力”到“操纵张力”、从“单细胞”到“超细胞网络”、从“个体事件”到“群体竞争(嵌合类器官、挤出富集)”的一整套闭环工具箱。
近岸蛋白相关产品
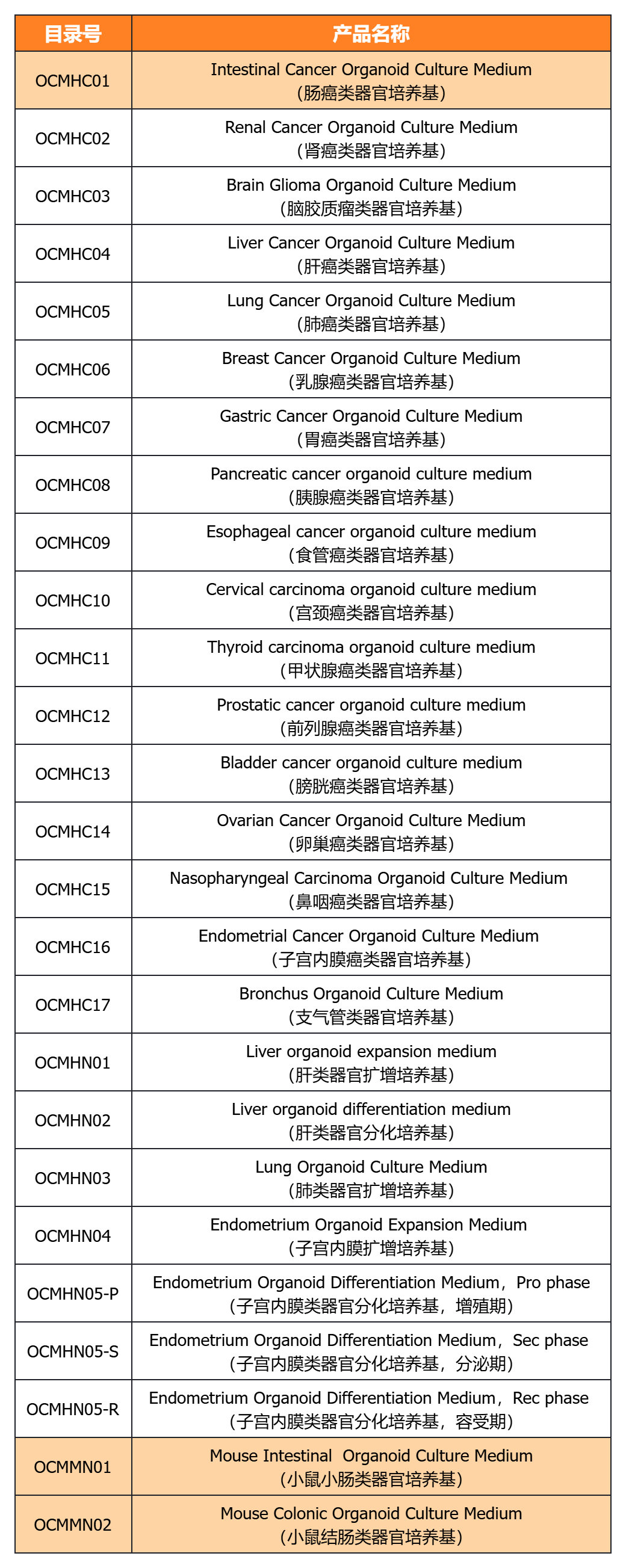
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
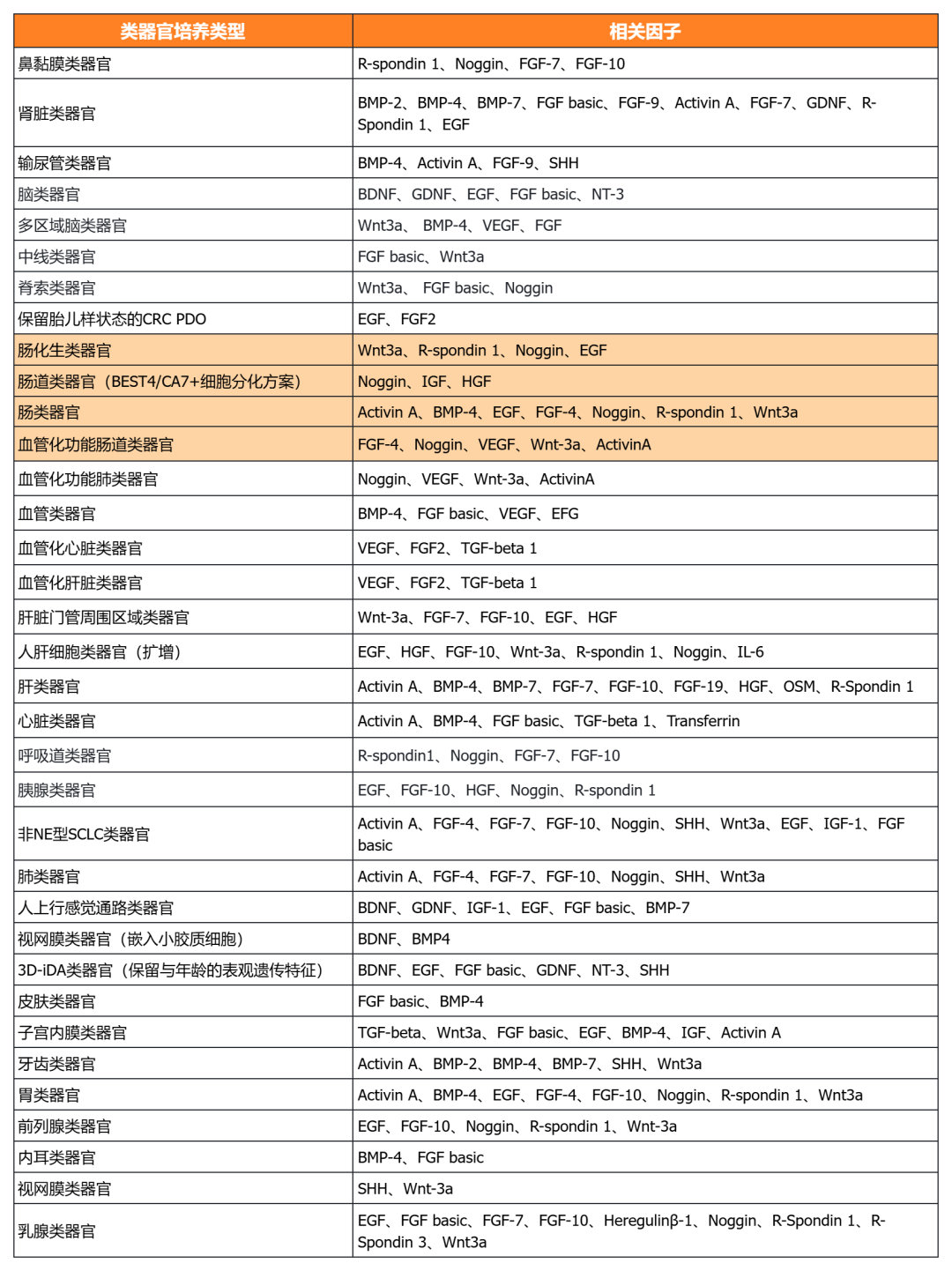
经类器官培养验证的细胞因子
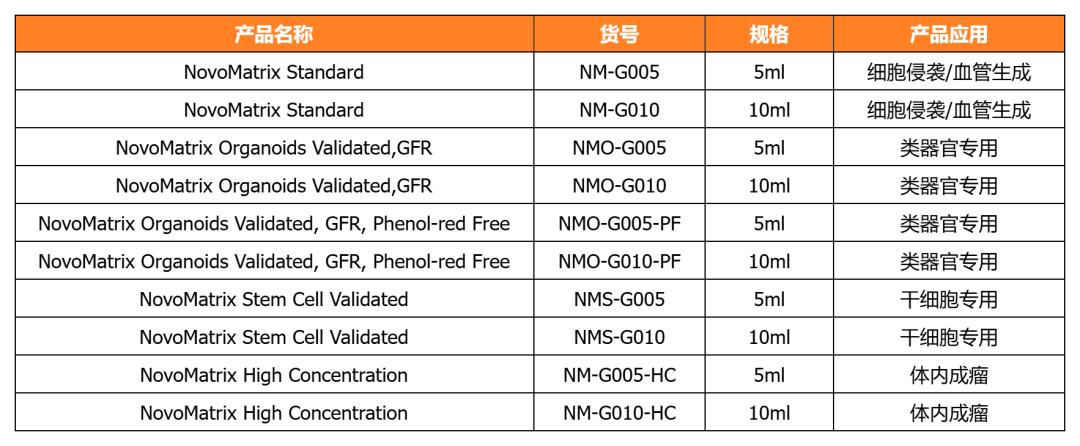
NovoMatrix 基质胶
参考资料
Krueger D, Spoelstra WK, Mastebroek DJ, et al. Epithelial tension controls intestinal cell extrusion. Science. 2025;389(6764):eadr8753. doi:10.1126/science.adr8753
